Khả năng tạo ra đề kháng của vi sinh vật nhanh hơn so với việc tạo ra các kháng sinh mới và hiệu quả; do đó, điều quan trọng là phải phát triển các tác nhân và phương pháp điều trị kháng sinh mới để kiểm soát nhiễm trùng do vi khuẩn. Một giải pháp thay thế cho vấn đề toàn thế giới này là sử dụng vật liệu nano có đặc tính kháng khuẩn. Các hạt nano bạc (AgNPs) đã được nghiên cứu rộng rãi do tác dụng kháng khuẩn của chúng đối với các sinh vật khác nhau. Mục đích của nghiên cứu này là đánh giá mức độ hiệu quả của các hạt nano bạc khi kết hợp với kháng sinh, giúp tăng hiệu quả và giảm tải lượng kháng sinh sử dụng.
Trong nghiên cứu này, tác dụng kháng khuẩn hiệp đồng của AgNPs và các kháng sinh thông thường đã được đánh giá ở vi khuẩn Gram dương và Gram âm. Nồng độ ức chế tối thiểu của AgNPs là 10–12 μg/ml (ppm) trong tất cả các chủng vi khuẩn được thử nghiệm, bất kể mức độ nhạy cảm khác nhau của chúng đối với kháng sinh.
Điều thú vị là, tác dụng kháng khuẩn hiệp đồng đã được quan sát thấy khi kết hợp AgNPs và kanamycin theo chỉ số nồng độ ức chế phân đoạn, FICI: <0,5), một phụ gia hiệu quả khi kết hợp AgNPs và chloramphenicol (FICI: 0,5 đến 1), trong khi không có tác dụng nào được tìm thấy với AgNPs kết hợp kháng sinh nhóm β-lactam. Phép đo dòng chảy tế bào và phân tích TEM cho thấy rằng nồng độ sublethal của AgNPs (6–7 μg mL -1) làm thay đổi điện thế màng vi khuẩn và gây ra tổn thương siêu cấu trúc, làm tăng tính thấm của màng tế bào. Không có tương tác hóa học nào giữa AgNP và kháng sinh được phát hiện.
Chúng tôi đề xuất một cơ chế hoạt động được hỗ trợ thử nghiệm trong đó tác động tổ hợp của các chất kháng khuẩn thúc đẩy sức mạnh tổng hợp tùy thuộc vào mục tiêu cụ thể của chúng, tạo điều kiện thuận lợi bởi sự thay đổi màng do AgNPs tạo ra. Kết quả của chúng tôi cung cấp cho sự hiểu biết sâu hơn về cơ chế hiệp đồng của AgNP và thuốc kháng sinh, nhằm mục đích chống lại nhiễm trùng do kháng sinh một cách hiệu quả, đặc biệt là chủng vi khuẩn đa kháng thuốc, nhằm giảm thiểu cuộc khủng hoảng hiện nay do kháng kháng sinh.
Quý khách hàng có nhu cầu nano bạc nguyên liệu SILMAT 15000 ppm dùng trong thú y chăn nuôi, thủy sản vui lòng liên hệ Hotline 0909.680.275 hoặc (028).62.714.788
Nội dung bài viết
Giới thiệu
Các bệnh truyền nhiễm do vi khuẩn gây bệnh gây ra là một trong những nguyên nhân gây tử vong phổ biến nhất trên toàn thế giới và là nguy cơ sức khỏe thường xuyên ở tất cả các quốc gia. Ngày nay, gánh nặng của bệnh truyền nhiễm đối với sức khỏe, kinh tế và các khía cạnh xã hội khác rất phức tạp, đến mức không thể ước tính được chi phí trên toàn thế giới. Các liệu pháp kháng sinh hiện nay có những nhược điểm đáng kể, chẳng hạn như tính đa dạng hạn chế, tương tác đối kháng và ảnh hưởng của các phương pháp điều trị kháng sinh chưa hoàn thành dẫn đến việc vi sinh vật kháng thuốc, trong số nhiều phương pháp khác.
Vi khuẩn đa kháng thuốc là một trong những vấn đề sức khỏe cộng đồng nghiêm trọng nhất trên toàn thế giới, và các chủng vi khuẩn kháng thuốc mới thường xuyên xuất hiện làm giảm hiệu quả của các phương pháp điều trị hiện tại, dẫn đến các nguy cơ sức khỏe cộng đồng nghiêm trọng. Nó cũng tác động tiêu cực đến một số lĩnh vực hoạt động của con người, chẳng hạn như nông nghiệp, nuôi trồng thủy sản và thú y. Thật không may, sự tiến hóa của vi khuẩn đa kháng đã vượt qua tốc độ phát triển của các loại kháng sinh mới; do đó, việc tạo ra các phương pháp điều trị kháng khuẩn mới và hiệu quả là rất quan trọng.
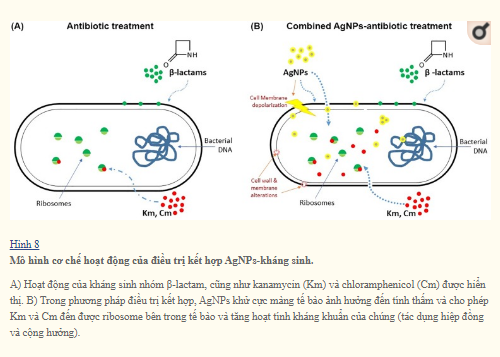
Các chiến lược để duy trì hiệu quả của kháng sinh đã được khuyến nghị. Một trong những giải pháp thay thế để chống lại các sinh vật đa kháng thuốc là sử dụng thuốc kháng sinh nano (vật liệu nano có đặc tính kháng khuẩn. Do đặc tính kháng vi-rút và kháng khuẩn, các hạt nano bạc (AgNPs) là chất kháng sinh nano hứa hẹn nhất hiện nay. Ưu điểm của AgNPs là một phương thức hoạt động tổng quát chống lại các mầm bệnh khác nhau, chẳng hạn như vi rút, vi khuẩn và nấm; cũng như hiệu quả kháng khuẩn của chúng không phụ thuộc vào tính nhạy cảm của vi sinh vật đối với các kháng sinh thông thường, bao gồm cả máy bơm dòng chảy và sự hình thành màng sinh học, do đó AgNPs có thể vượt qua khả năng đề kháng của vi sinh vật đối với các kháng sinh thông thường. Hơn nữa, việc sử dụng AgNPs có những ưu điểm khác ngoài hoạt động kháng vi-rút và kháng khuẩn của chúng. AgNPs có thể được tổng hợp bằng các phương pháp dễ dàng, không tốn kém và thân thiện với môi trường, và chúng có thể được sản xuất bằng các quy trình hóa học hoặc sinh tổng hợp. AgNPs cho thấy một phương thức tác động nhiều cấp độ trên tế bào vi khuẩn ảnh hưởng đến quá trình trao đổi chất: A) phá vỡ thành tế bào và màng tế bào và tăng tính thấm của tế bào; B) Sự xâm nhập của nano bạc và tổn thương nội bào làm gián đoạn các con đường trao đổi chất; C) tổn thương các phân tử sinh học (DNA, protein); và D) phản ứng tạo ôxy . Đối với các đánh giá gần đây, hãy xem.
Gần đây, sự cải thiện hoạt động kháng khuẩn – tác dụng hiệp đồng – đã được báo cáo khi AgNPs được kết hợp với một số kháng sinh, chẳng hạn như ampicillin, amoxicillin và chloramphenicol. Ngược lại, các báo cáo cho thấy có sự tương tác đối kháng giữa AgNPs và amoxicillin hoặc oxacillin. Các nghiên cứu tập trung vào cơ chế hoạt động của sự kết hợp NPs-kháng sinh đã gợi ý rằng sự cải thiện hoạt tính kháng khuẩn có thể là do tương tác hóa học của chúng, tuy nhiên, cơ chế phân tử cơ bản của tác dụng, hiệp đồng hoặc đối kháng, vẫn cần được làm rõ.
Với sự hiện diện của các báo cáo trái ngược nhau, chúng tôi quan tâm đến việc đánh giá hoạt động kháng khuẩn của nano bạc kết hợp với kháng sinh của các mục tiêu tế bào khác nhau và do đó, các cơ chế hoạt động khác nhau. Chúng tôi đã chọn chloramphenicol (Cm), kanamycin (Km), ampicillin (Amp), aztreonam (Azm) và biapenem (Bpm). Hiệu quả nâng cao của sự kết hợp kháng sinh AgNPs được đặc trưng bởi các kỹ thuật phân tích khác nhau để làm sáng tỏ các cơ chế kháng khuẩn có liên quan. Vì sức mạnh tổng hợp có liên quan nhiều đến các liệu pháp tổ hợp kháng khuẩn, chúng tôi đã khám phá cả vi khuẩn Gram dương và Gram âm. Chúng tôi có thể xác định rằng AgNPs làm thay đổi tính toàn vẹn và tiềm năng của màng tế bào, làm tăng tính thấm của tế bào và tạo điều kiện cho kháng sinh tiếp cận nội bào,
Vật liệu và phương pháp
1. Đặc tính của các hạt nano bạc (AgNPs)
Argovit AgNPs được lấy từ Vector Vita Ltd (Novosibirsk, Nga). Chúng được ổn định bằng cách sử dụng polyvinylpyrrolidone (PVP). Nano bạc được đặc trưng bởi các phương pháp hóa lý ( Hình S1 ). Tóm lại, cộng hưởng plasmon bề mặt được đặc trưng bởi phép đo quang phổ UV-Vis (Multiskan Go, Thermo Scientific) trong phạm vi từ 270 đến 600 nm. Hình thái và thành phần hóa học của AgNPs được kiểm tra trong TEM (Jeol JEM 2100). Ngoài ra, phân tích thành phần nguyên tố (EDX) đã được thực hiện để xác nhận sự hiện diện của bạc. Đường kính thủy động lực học trung bình của chúng và độ ổn định của nano bạc được đo bằng phương pháp tán xạ ánh sáng động (DLS) sử dụng Zeta sizer nano.
2. Chủng và điều kiện nuôi cấy vi khuẩn
Các thí nghiệm được thực hiện trên bốn chủng vi khuẩn. Gram âm: Escherichia coli DH5α (không gây bệnh) và Salmonella enterica serovar Typhimurium ATCC SC14028 ( S. Typhimurium) (gây bệnh); Gram dương: Staphylococcus aureus (phân lập lâm sàng, gây bệnh) và Bacillus subtilis (không gây bệnh), từ bộ sưu tập được lưu giữ tại Centro de Nanociencias y Nanotecnologia — Universidad Nacional Autónoma de México. Đối với các thí nghiệm, tất cả các vi khuẩn đều được nuôi trong môi trường Muller-Hinton (MH). Đối với đĩa MH, 1,5% thạch đã được thêm vào. Các mẫu cấy được ủ trong 24 giờ, 37 ° C và 180 vòng / phút.
3. Tác nhân kháng khuẩn
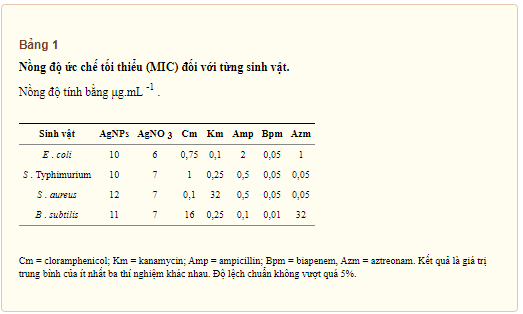
Thuốc kháng sinh: chloramphenicol (Cm), kanamycin (Km), biapenem (Bpm), và aztreonam (Azm) được lấy từ Sigma-Aldrich (Mỹ), và ampicillin (Amp) từ Duchefa Biochemie (Mỹ). Phạm vi nồng độ của kháng sinh được lựa chọn dựa trên hướng dẫn giao thức CLSI M100 và Vazquez-Muñoz, et . al ., 2017 cho AgNPs. Nồng độ ức chế tối thiểu (MIC) được xác định đối với AgNPs và tất cả các kháng sinh được sử dụng trong nghiên cứu này (Bảng 1). Nồng độ sublethal cho các xét nghiệm hiệu ứng tổ hợp được lựa chọn dựa trên MIC ( Bảng S1 ).
4. Hoạt động kháng khuẩn của AgNPs, AgNO 3 và kháng sinh
Nồng độ ức chế tối thiểu (MIC) và nồng độ sublethal được xác định đối với nano bạc, AgNO 3 và kháng sinh. MIC được đánh giá theo giao thức M07-A9 của Viện Tiêu chuẩn Phòng thí nghiệm Lâm sàng, với một số sửa đổi. Nồng độ của Sublethal được xác định bằng quang học bằng phép đo quang phổ UV-Vis, ở bước sóng 600 nm. Như đối chứng, đối với mỗi nồng độ AgNPs và AgNO 3 được thử nghiệm, một dung dịch không có chất cấy được sử dụng.
5. Phương pháp điều trị kháng sinh kết hợp AgNPs
Hoạt động kết hợp của nồng độ sublethal của AgNPs (6 μg.mL -1 ) với các kháng sinh khác nhau được đánh giá bằng phương pháp pha loãng vi lượng. Đối với mỗi loại kháng sinh, nồng độ dưới mức gây chết người được sử dụng là một nửa MIC ( Bảng 1 ). Khi đối chứng, vi khuẩn được tiếp xúc riêng biệt với nồng độ dưới mức gây chết của AgNPs và kháng sinh tương ứng. Các tế bào được ủ trong các điều kiện phòng thí nghiệm tiêu chuẩn (37 ° C và 180 vòng / phút), trong các đĩa 96 giếng trong 24 giờ. Sự ức chế sự phát triển của vi khuẩn được xác định bằng phương pháp quang phổ ở bước sóng 600 nm. Để xác định tác dụng tương tác của kháng sinh và nano bạc, chỉ số nồng độ ức chế phân đoạn (FICI) sửa đổi theo Tỷ lệ, đã được dùng. FICI cho rằng sự kết hợp theo cặp của các tác nhân có thể gây ra tác dụng ức chế lớn hơn tổng tác dụng của chúng đơn lẻ (sức mạnh tổng hợp; FICI ≤0,5), hoặc ít hơn tổng tác dụng của chúng đơn lẻ (đối kháng; FICI> 4) . Đối với nghiên cứu này, một hiệu ứng cộng được xem xét khi giá trị FICI> 0,5 và ≤1. FICI được xác định bằng cách tính toán tỷ lệ phần trăm ức chế sự phát triển của vi khuẩn đối với AgNP và kháng sinh theo công thức:
6. Đặc điểm tương tác giữa nano bạc -kháng sinh bằng phân tích quang học
Phương pháp điều trị kết hợp AgNPs-kháng sinh được phân tích bằng quang phổ hồng ngoại Fourier Transformer (FT-IR) để đánh giá tương tác hóa học tiềm ẩn giữa AgNPs và kháng sinh. Các nghiệm thức kết hợp được ủ trong nước khử ion ở điều kiện tiêu chuẩn và sau đó được đông khô. Cuối cùng, các mẫu được ly tâm và trộn thành viên với kali bromua (KBr). Phân tích FT-IR được thực hiện trên máy quang phổ FT-IR của Nicolet 6700, Thermo Scientific ® , trong phạm vi từ 4000 đến 400 cm -1 .
Phân tích tán xạ ánh sáng động (DLS) được thực hiện để đánh giá độ ổn định của AgNPs khi tiếp xúc với kháng sinh dựa trên những thay đổi về sự kết tụ (đường kính thủy động) và điện tích (thế Z). AgNPs (50 μg.mL -1 ) trộn với kháng sinh (100 μg.mL -1 ) được pha loãng trong nước khử ion và đo ở 0 giờ và 24 giờ, trong điều kiện nuôi cấy (37 ° C, 180 vòng / phút). Phân tích DLS được thực hiện trong hệ thống Zetasizer Nano ZS (Malvern).
7. Phân tích siêu cấu trúc bằng Kính hiển vi điện tử truyền qua (TEM)
Ảnh hưởng của AgNP đến cấu trúc thành tế bào vi khuẩn và khả năng tích lũy sinh học của chúng được đánh giá bằng kính hiển vi điện tử. E . coli , S . aureus , S . Typhimurium và B . subtilis được tiếp xúc với nồng độ dưới mức gây chết của AgNPs và AgNO 3 ( tương ứng là 6 và 4 μg.mL -1 ), và được ủ trong các điều kiện tiêu chuẩn. Sau đó, các tế bào vi khuẩn được ly tâm, cố định bằng glutaraldehyde (2%), và sau đó cố định bằng OsO 4(1%). Các mẫu được khử nước và ngấm vào nhựa của Spurr. Các mẫu polyme hóa được cắt thành từng phần (100 nm) trong PowerTome X siêu siêu nhỏ (RMC Boeckeler). Các thanh trượt được gắn trong các lưới đồng 300 mesh được phủ bằng carbon có ren (Ted Pella). Phân tích siêu cấu trúc được thực hiện với TEM Jeol JEM-2010 (CNyN, UNAM) và TEM Jeol JEM-1230 tại 80 KeV (Khoa Bệnh lý, Viện Tim mạch Quốc gia). Mặt khác, sự tương tác giữa AgNPs-kháng sinh được đánh giá bằng cách trộn AgNPs và kháng sinh riêng biệt trong 24 giờ. AgNPs (50 μg.mL -1 ) trộn với kháng sinh (100 μg.mL -1 ) được pha loãng trong nước khử ion. Một giọt hỗn hợp được đặt trong lưới đồng 300 mesh được phủ bằng carbon có ren (Ted Pella), được làm khô và quan sát bằng TEM.
8. Ảnh hưởng của nano bạc đến tiềm năng và tính thấm của màng tế bào vi khuẩn
Ảnh hưởng của AgNPs trên phân cực màng tế bào được đánh giá theo quy trình do Novo và Perlmutter đề xuất. (Tóm lại, mỗi dòng vi khuẩn E . Coli , S . Typhimurium, S . Aureus và B . Subtilis ) đã được nuôi trong điều kiện tiêu chuẩn và điều chỉnh tới 1 x 10 6 tế bào mỗi mL trong vô trùng 1x PBS. Nuôi cấy vi khuẩn được tiếp xúc với 10 μg.mL -1 của AgNPs hoặc AgNO 3và nhuộm với 18 μM DiOC6 (Sigma-Aldrich, Mỹ). Các mẫu đối chứng dương tính được tiếp xúc với 50 μM CCCP (Sigma-Aldrich, Hoa Kỳ). Các tế bào được ủ ở nhiệt độ phòng trong 1 giờ và được phân tích trong máy đo dòng chảy Attune (Thermo Scientific), với tia laser phát ra ở bước sóng λ = 488 nm. Huỳnh quang được thu thập bằng cách sử dụng các kênh màu xanh lá cây và màu đỏ. Dữ liệu phân tán phía trước, phân tán bên và huỳnh quang được thu thập bằng cách khuếch đại tín hiệu logarit. Để đánh giá tính thấm của màng, mỗi chủng được nuôi cấy trong cùng điều kiện và tiếp xúc với AgNPs hoặc AgNO 3như đã mô tả ở trên. Các tế bào được nhuộm bằng thuốc thử khả năng tồn tại của tế bào alamarBlue (Thermo Scientific) và 75 nM propidium iodide. Các tế bào được ủ ở 37 ° C trong 1 giờ và được phân tích bằng phép đo dòng chảy với tia laser màu tím và xanh lam phát ra lần lượt ở bước sóng λ = 405 và 488 nm. Sự phát huỳnh quang được ghi lại với các kênh VL3 và BL3 như đã mô tả trước đây.
Kết quả
1. Đặc tính của các hạt nano bạc (AgNPs)
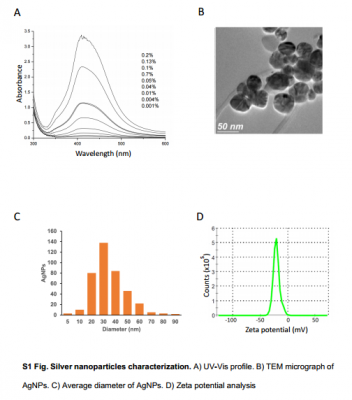
Công thức AgNP của Argovit được sử dụng trong nghiên cứu này chứa 1,2% bạc kim loại được ổn định với 18,8% polyvinylpyrolidone (PVP) trong nước (Vector-Vita Ltd). Hồ sơ UV-Vis của AgNPs cho thấy một đỉnh ở 400 nm, tương ứng với cộng hưởng plasmon bề mặt điển hình của AgNPs. Ảnh hiển vi TEM cho thấy AgNP có hình cầu và đường kính trung bình của chúng là 35 ± 15 nm. Phân tích thành phần nguyên tố (EDX) đã xác nhận sự có mặt của bạc. Đường kính thủy động lực học trung bình của chúng là 70,4 ± 0,5 nm, và giá trị điện thế zeta của chúng là -18 ± 1,1 mV. ( Hình S1 ). Nồng độ AgNPs được tính theo hàm lượng bạc kim loại.
2. Nồng độ ức chế tối thiểu (MIC) của AgNPs, AgNO 3 và kháng sinh
Cả hai chủng vi khuẩn Gram âm và Gram dương đều được ủ với các nồng độ kháng sinh khác nhau để thu được nồng độ ức chế tối thiểu (MIC) và nồng độ sublethal. E . coli , S . Typhimurium, B . subtilis và S . aureus bị ức chế ở khoảng nồng độ từ 10 đến 12 μg.mL -1 của AgNP và 6–7 μg.mL -1 của AgNO 3 . Ngược lại, tất cả các chủng đều cho thấy sự nhạy cảm khác nhau đáng chú ý với các kháng sinh được thử nghiệm, với MIC dao động từ 0,05 đến 32 μg.mL -1 (Bảng 1). Theo các tiêu chuẩn lâm sàng và phòng thí nghiệm Viện standars (CLSI) trong hướng dẫn M100-S17, kết quả của chúng tôi cho thấy S . aureus kháng chỉ Km (32 μg.mL -1 ), trong khi B . subtilis kháng Cm và Azm ( tương ứng 16 và 32 μg.mL -1 ). E . coli và S . Tính nhạy cảm với typhimurium được phát hiện đối với tất cả các loại kháng sinh được thử nghiệm (<2 μg.mL -1 ). Điều thú vị là kết quả của MBC và MIC đều giống nhau đối với tất cả các chủng vi khuẩn trong nghiệm thức AgNPs và AgNO 3 (dữ liệu không được hiển thị).
3. Hoạt động kháng khuẩn của các phương pháp điều trị kháng sinh kết hợp AgNPs
Khi giá trị MIC được xác định cho tất cả các chất kháng khuẩn, nồng độ dưới mức gây chết của các phương pháp điều trị kháng sinh kết hợp nano bạc được đánh giá để xác định tác dụng hiệp đồng. Nồng độ sublethal được sử dụng cho nano bạc là 6 μg.mL -1 , và một nửa MIC cho mỗi loại kháng sinh ( Bảng S1 ). Khi đối chứng, vi khuẩn được tiếp xúc riêng với nồng độ dưới mức gây chết của AgNPs và thuốc kháng sinh.
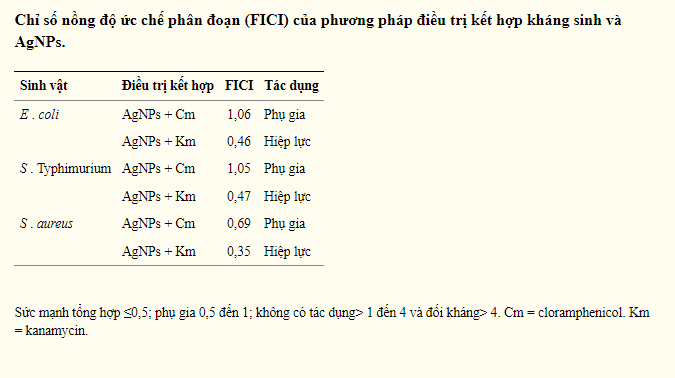
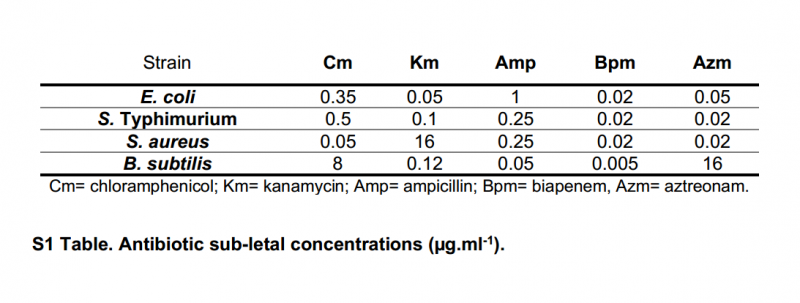
Sự kết hợp AgNPs-Cm gây ra xung quanh sự ức chế tăng trưởng 50% so với E . coli , S . Typhimurium, và S . aureus , trong khi AgNPs-Km gây ra sự ức chế tăng trưởng đáng kể trên cùng một chủng (khoảng 95%) (Hình 1). Chỉ số nồng độ ức chế phân đoạn (FICI) được tính toán cho mỗi sự kết hợp nano bạc -kháng sinh. Đối với nghiên cứu này, sức mạnh tổng hợp được báo cáo trong các trường hợp là FICI ≤0,5, một hiệu ứng phụ khi giá trị FICI nằm trong khoảng từ 0,5 đến 1, và đối kháng với FICI> 4. Không có ảnh hưởng nào được xem xét đối với FICI> 1 đến <4. Điều thú vị là, sự khác biệt thống kê đã được quan sát thấy khi kết hợp với một trong hai AgNPs Km hoặc Cm trong E . coli , S . Typhimurium và S . aureus , tương ứng (Hình 1 và bảng 2). Tuy nhiên, tác dụng hiệp đồng chỉ được quan sát thấy đối với các tổ hợp Km trong khi chỉ có tác dụng cộng hưởng được xác định đối với AgNPs-Cm. Không có tác dụng đã được quan sát thấy khi kết hợp không AgNPs bằng kháng sinh β-lactam cho bất kỳ vi sinh vật thử nghiệm, cũng không phải bất kỳ điều trị trong B . subtilis (Hình 1).
Hình 1: Ảnh hưởng đến hoạt tính kháng khuẩn của phương pháp điều trị AgNPs-kháng sinh kết hợp của E . coli , S . Typhimurium, S . aureus , và B . subtilis. Các thí nghiệm được thực hiện trong ba lần. Những thay đổi đáng kể được đánh dấu bằng dấu hoa thị: * p-value: <0,05
Đặc điểm quang phổ DLS và FT-IR của các phương pháp điều trị kháng sinh và AgNP kết hợp
Để xác định liệu có sự tương tác trực tiếp giữa nano bạc và thuốc kháng sinh hay không, chúng tôi đã thực hiện phân tích FT-IR và DLS của các loại thuốc kháng sinh khác nhau và AgNP, trong các phương pháp điều trị đơn lẻ hoặc kết hợp. Các cấu hình truyền FT-IR của các phương pháp điều trị kháng sinh kết hợp AgNPs có các đỉnh đặc trưng của cả PVP-AgNPs và kháng sinh tiêu chuẩn ( Hình 2 ). Do đó, phân tích quang phổ truyền qua không cho thấy bằng chứng nào về liên kết hóa học cộng hóa trị giữa nano bạc và kháng sinh.
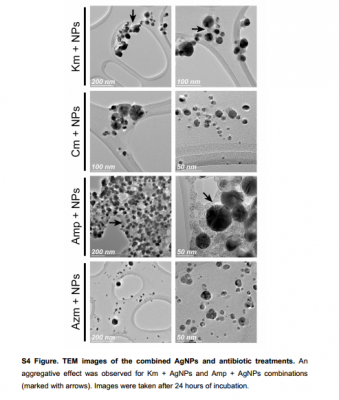
Mặt khác, phân tích DLS cho thấy Km và Amp có ảnh hưởng đến kích thước và điện tích AgNPs ( Hình 3 ). Những thay đổi về kích thước và điện tích có thể là do tương tác tĩnh điện giữa AgNPs và thuốc kháng sinh, trong đó Km và Amp có thể được hấp thụ xung quanh AgNPs hoặc gây ra sự kết tụ của chúng. Trong một số trường hợp, những khác biệt này thể hiện rõ với sự thay đổi màu sắc trong hỗn hợp kháng sinh-AgNPs (dữ liệu không được hiển thị). Để làm rõ kết quả DLS, chúng tôi đã phân tích kích thước và trạng thái kết tụ của các AgNP khi kết hợp với Km và Amp bằng Kính hiển vi điện tử truyền qua (TEM). Phù hợp với dữ liệu DLS, sự kết tụ AgNPs được quan sát thấy đối với hỗn hợp AgNPs-Km và AgNPs-Amp, trong khi không quan sát thấy sự kết tụ khi kết hợp AgNPs với Cm hoặc Azm ( Hình 4 ).
Ảnh hưởng của nano bạc đến siêu cấu trúc tế bào
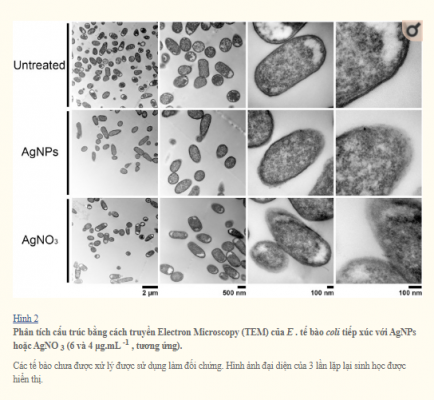
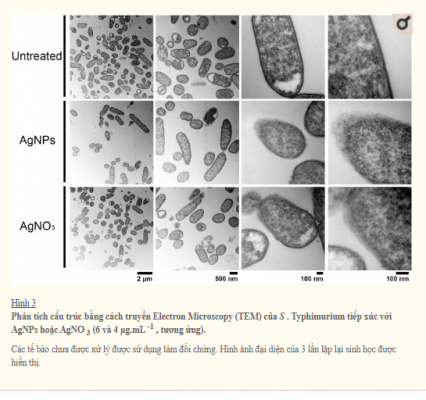
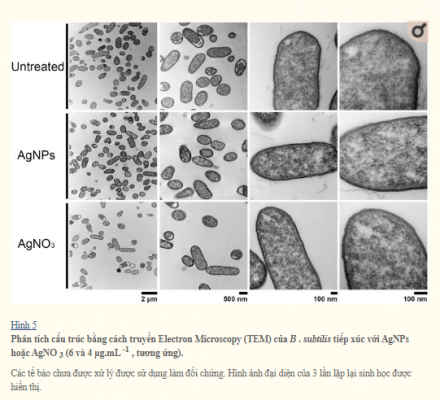
Để so sánh ảnh hưởng đến tính toàn vẹn của màng tế bào của các NP, các chủng vi khuẩn được xử lý với nồng độ AgNPs và AgNO3 dưới mức gây chết người , và hình thái tế bào được hiển thị bằng TEM (Hình 5). So với các tế bào không được điều trị, cả hai AgNPs và AgNO3 phương pháp điều trị phá vỡ E . coli và S . Màng tế bào typhimurium, có thể thấy do màng tế bào bị mất tính toàn vẹn cho thấy ảnh hưởng trực tiếp của các ion bạc đối với sự ổn định của màng tế bào (Hình 2 và 3). Điều thú vị là cho B . subtilis và S . aureus (cả Gram dương), tiếp xúc với nồng độ AgNPs hoặc AgNO3 dưới mức gây chết người, không gây ra thiệt hại rõ ràng (Hình 4 và 5).
Đối với E . coli , S . Typhimurium và S . aureus , nồng độ sublethal của các nghiệm thức kết hợp AgNPs-Km và AgNPs-Cm cho thấy tác dụng hiệp đồng và cộng hưởng tương ứng (bảng 2, Hình 1). Đúng như mong đợi, phân tích TEM dưới hai phương pháp điều trị kết hợp này cho thấy tổn thương tế bào đáng kể xác nhận các xét nghiệm MIC và chỉ ra cái chết của tế bào vi khuẩn ( Hình 5 ).
4. Ảnh hưởng của nano bạc đến tiềm năng và tính thấm của màng tế bào
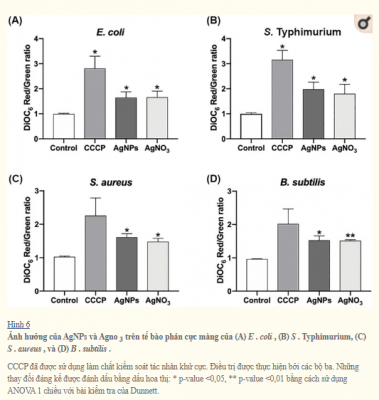
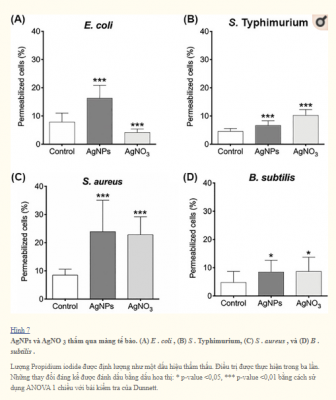
Tổn thương màng Gram âm có thể giải thích tác dụng diệt khuẩn của AgNPs khi được kết hợp với Km hoặc Cm. Tuy nhiên, đối với S . aureus không có thay đổi cấu trúc nào được quan sát nhưng một tác động cộng hưởng và cộng hưởng đáng kể đã được phát hiện đối với Km và Cm, tương ứng. Các báo cáo trước đây cho rằng AgNPs và AgNO 3 gây ra sự khử cực và mất ổn định màng dẫn đến tác dụng diệt vi sinh vật của AgNPs và AgNO3. Để đánh giá sự khử cực và tính thấm của màng, chúng tôi phân tích các tế bào vi khuẩn được xử lý với nồng độ AgNPs hoặc AgNO 3 dưới mức gây chết bằng phương pháp đo tế bào dòng chảy. Điều thú vị là AgNPs và AgNO 3 màng vi khuẩn khử cực sau 30 phút tiếp xúc, và những tác động này không rõ ràng đối với vi khuẩn Gram âm và Gram dương (Hình 6). Hơn nữa, tính thấm cũng bị thay đổi do thay đổi điện thế màng trong tế bào tiếp xúc với AgNPs và AgNO3 ở tất cả các chủng được thử nghiệm (Hình 7).
Thảo luận
Phù hợp với phân tích so sánh trước đây, nồng độ ức chế tối thiểu (MIC) của nano bạc và AgNO 3 là tương tự nhau trong tất cả các chủng vi khuẩn được thử nghiệm, bất kể sự khác biệt về cấu trúc hoặc sinh lý của chúng, với hầu hết các giá trị MIC trong khoảng 6–12 μg.mL -1 , và cùng nồng độ NPs được xác định đối với nồng độ diệt khuẩn tối thiểu (MBC) (Bảng 1) . Ngược lại, tính nhạy cảm với kháng sinh có thể thay đổi giữa các chủng.
Phân tích TEM cho thấy nano bạc ảnh hưởng đáng kể nguyên vẹn của màng tế bào của vi khuẩn Gram âm như E . coli và S . Typhimurium. Tuy nhiên, trong phương pháp điều trị trên vi khuẩn Gram dương ( S . Aureus và B . Subtilis ), không có sự gián đoạn vách tế bào đã được quan sát (Hình 4 và 5). Mặt khác, nồng độ AgNPs dưới mức gây chết người khử cực màng tế bào ở tất cả các vi khuẩn được phân tích, dẫn đến tăng tính thấm của tế bào (Hình 6), bất kể sự khác biệt về thành phần thành tế bào giữa vi khuẩn Gram dương và Gram âm. Sự gia tăng tính thấm màng này có thể tạo điều kiện cho kháng sinh xâm nhập vào tế bào, cho phép kháng sinh nội bào có hiệu quả cao hơn (Hình 7).
Nano bạc và các phương pháp điều trị kết hợp kháng sinh đã được nghiên cứu trước đây nhưng không có cơ chế hoạt động nào được thiết lập vì các kiểu hình khác nhau đã được phát hiện giữa các nghiên cứu. Hơn nữa, ảnh hưởng của hoạt tính kháng sinh AgNPs có thể khác nhau ở các sinh vật khác nhau. Sự khác biệt này được tìm thấy về AgNPs-kháng sinh tổng hợp có thể được giải thích bởi các yếu tố khác nhau: chất ổn định được sử dụng và nồng độ tương đối của nó, có thể ảnh hưởng đến khả năng tương tác giữa AgNPs và kháng sinh. AgNPs được chức năng hóa với PVP cho thấy khả năng kháng khuẩn hiệp đồng tốt hơn với kháng sinh so với những chất được ổn định với citrate hoặc SDS. Hơn nữa, tương tác của AgNP được ổn định bằng citrate và ampicillin đã được báo cáo, trong khi AgNP được ổn định với PVP không cho thấy tương tác như vậy (công việc này), điều này cho thấy rằng chất ổn định đóng vai trò trung tâm trong loại tương tác này và đồng thời với tương tác kháng khuẩn (hiệp đồng, phụ gia hoặc không tác dụng).
Trong nghiên cứu này, AgNPs-Km kết hợp cho thấy một tác dụng hiệp đồng trên vi khuẩn phát triển trong E . coli , S . Typhimurium và S . aureus ; trong khi sự kết hợp AgNPs-Cm thể hiện tác dụng phụ gia (nhưng vẫn đáng kể) trên cùng các chủng vi khuẩn (Hình 1 và bảng 2). Panacek và cộng sự (2015) đã báo cáo sự tương tác hiệp đồng giữa các kháng sinh có phương thức tác dụng khác nhau và các AgNP, bao gồm cả các kháng sinh AgNPs-β-lactam. Tuy nhiên, điều quan trọng là cần lưu ý rằng E . Chủng coli được sử dụng trong nghiên cứu này cho thấy khả năng kháng ampicillin ngay cả khi không điều trị bằng AgNPs, và tình trạng kháng ampicillin này được khắc phục khi kết hợp AgNPs-ampicillin. Một hiệu ứng tương tự đã được tìm thấy đối với một S được phân lập lâm sàng . chủng aureus , cho thấy khả năng chống lại Km, tuy nhiên, khi kết hợp điều trị AgNPs-Km, chúng tôi cũng quan sát thấy một hiệu ứng hiệp đồng (Hình 1 và bảng 2). Sức mạnh tổng hợp giữa nano bạc và kháng sinh trước đây cũng được cho là do liên kết hóa học giữa nhóm kháng sinh lưu huỳnh với AgNPs, nhưng không có bằng chứng thực nghiệm thuyết phục nào được cung cấp để hỗ trợ giả thuyết này. Deng và cộng sự . đã báo cáo tác dụng hiệp đồng và tương tác giữa AgNPs và một số kháng sinh (enoxacin, kanamycin, neomycin và tetracycline). Họ đề xuất rằng sự tương tác này thúc đẩy sự gia tăng giải phóng các ion Ag, đồng thời làm tăng sự ức chế sự phát triển của vi khuẩn ở Salmonella sp. Tuy nhiên, kết quả của chúng tôi cho thấy không có thay đổi nào trong các thí nghiệm FT-IR cho thấy không có tương tác hóa học cộng hóa trị giữa nano bạc và các kháng sinh được thử nghiệm (Hình 2 ). Đối với phân tích DLS, sự thay đổi điện tích bề ngoài được phát hiện trên AgNP kết hợp với Km hoặc Amp, cho thấy tương tác tĩnh điện. Ngoài ra, tổ hợp AgNPs-Km cũng cho thấy sự gia tăng kích thước tỷ lệ thủy động lực học ( Hình 3 ). Trong hình ảnh TEM, sự kết tụ AgNPs-Km hoặc AgNPs-Amp được quan sát ( Hình 4 ). Tuy nhiên, không tìm thấy mối tương quan trực tiếp giữa tác dụng kháng khuẩn nâng cao và những thay đổi trong tương tác, kích thước hoặc điện tích của AgNPs. Do đó, có vẻ như những đặc điểm này không cần thiết cho tác dụng diệt khuẩn của các phương pháp điều trị kết hợp. Điều thú vị là, nhất quán với các nghiên cứu khác, AgNPs làm thay đổi tính toàn vẹn của màng và tăng tính thấm của tế bào (Hình 6 và 7).
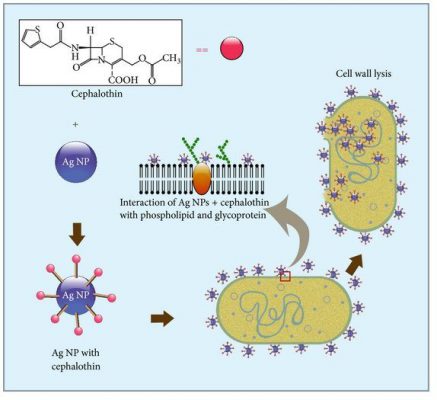
Ở đây, chúng tôi đề xuất một cơ chế hoạt động của phương pháp điều trị kết hợp nano bạc -kháng sinh, trong đó AgNPs làm mất ổn định màng tế bào vi khuẩn, thúc đẩy nội chất kháng sinh trong tế bào và đồng thời với hoạt động diệt vi sinh vật (Hình 8).
Đối với những kháng sinh hoạt động bên trong tế bào, có thể quan sát thấy tác dụng cộng hưởng hoặc cộng hưởng vì AgNP tạo điều kiện thuận lợi cho việc xâm nhập tế bào kháng sinh và thúc đẩy việc tiếp cận mục tiêu của chúng (đối với Km và Cm, ribosome). Ngược lại, các kháng sinh nhóm β-lactam không có tác dụng cộng hưởng với AgNPs vì những kháng sinh này hoạt động bằng cách ảnh hưởng đến tính toàn vẹn của thành tế bào vi khuẩn, do đó tác dụng của chúng không bị ảnh hưởng bởi những thay đổi về tính thấm của tế bào và lối vào tế bào của kháng sinh.
Mô hình của chúng tôi cũng được hỗ trợ bởi những phát hiện của Deng, trong đó bốn loại kháng sinh nội bào cho thấy sức mạnh tổng hợp khi kết hợp với AgNPs. Ngoài ra, một báo cáo gần đây mô tả hoạt động tăng cường của ciprofloxacin và gentamicin, trong số những người khác, với cả tác dụng hiệp đồng và cộng hưởng, khi được áp dụng kết hợp với AgNPs . Điều quan trọng cần nhấn mạnh là tác dụng tăng cường ở các chủng kháng kháng sinh cao hơn so với các chủng nhạy cảm với kháng sinh, điều này có thể được giải thích bằng mô hình được đề xuất trong nghiên cứu của chúng tôi, trong đó AgNP ảnh hưởng đến màng tế bào và tính toàn vẹn của thành tế bào có lợi cho tác dụng của kháng sinh, dẫn đến tính nhạy cảm “được phục hồi” đối với một số chủng kháng kháng sinh.
Cơ chế sinh lý của tác dụng hiệp đồng của nano bạc và sự kết hợp kháng sinh được giải thích ở đây với sự hỗ trợ thực nghiệm. Kết quả của chúng tôi giúp làm sáng tỏ tác dụng hiệp đồng của những sự kết hợp này xảy ra như thế nào. Theo dữ liệu thực nghiệm của chúng tôi, việc tăng cường hoạt tính kháng khuẩn của kháng sinh là do tác động của AgNPs lên cấu trúc tế bào chứ không phải do tương tác trực tiếp với kháng sinh AgNPs.
Hiểu cơ chế hoạt động của thuốc kháng sinh, nano bạc và các phương pháp điều trị kết hợp cho phép dự đoán các phương pháp điều trị khả thi hơn và cải tiến hoặc thiết kế các phương pháp điều trị mới hiệu quả hơn. Ngay cả khi một số khía cạnh của cơ chế hoạt động vẫn chưa được biết, kết quả của chúng tôi góp phần cung cấp một cách hiệu quả hơn để chống lại các bệnh truyền nhiễm. Việc tăng cường hoạt động kháng khuẩn do kết hợp kháng sinh nano bạc sẽ cho phép sử dụng các loại kháng sinh đã không còn được sử dụng vì các vấn đề vi khuẩn kháng thuốc, cung cấp thêm khả năng điều trị trong các lĩnh vực chăm sóc sức khỏe, thú y và nông nghiệp. Do đó, thuốc kháng sinh nano có tác động tiềm tàng đến các vấn đề xã hội và kinh tế, vì chúng có thể giúp giảm thiểu cuộc khủng hoảng hiện nay do kháng kháng sinh.
Thông tin bổ sung
.
A) Hồ sơ UV-Vis. B) Ảnh hiển vi TEM của AgNPs. C) Đường kính trung bình của các AgNP. D) Phân tích tiềm năng Zeta
A) Ampicillin (Amp); B) Aztreonam (Azm); C) Kanamycin (Km); và D) Cloramphenicol (Cm). Phổ truyền của các kết hợp kháng sinh AgNP tương tự như phổ truyền của các kháng sinh và kháng sinh không kết hợp AgNP.
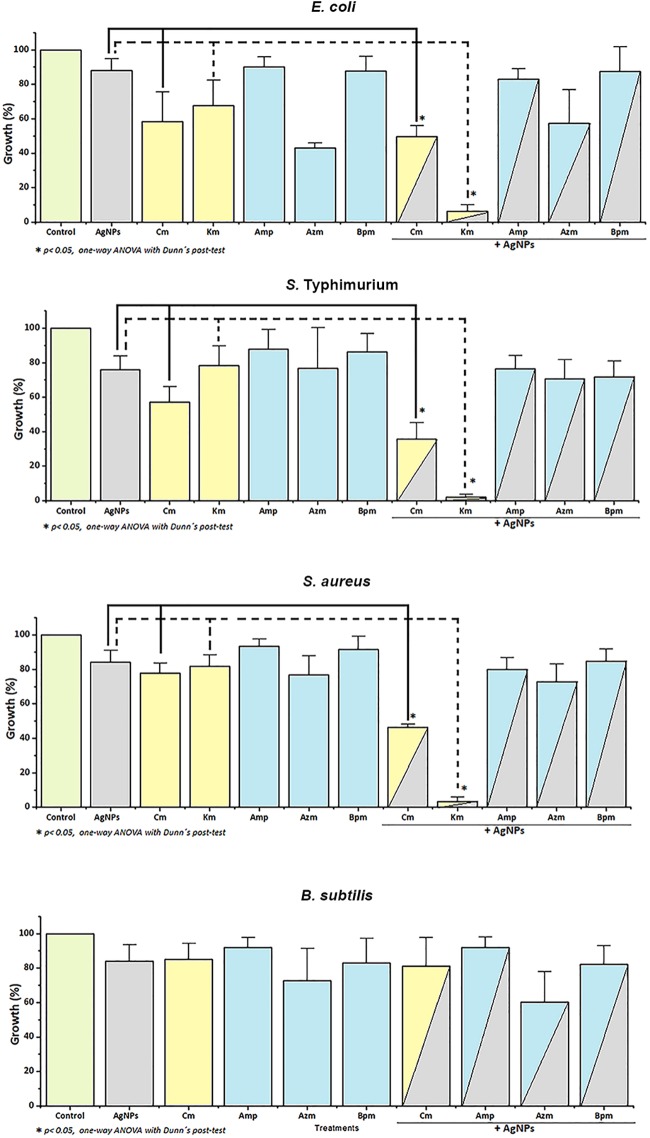
Hình S3. Phân tích DLS của các phương pháp điều trị kháng sinh và AgNP kết hợp ở 0 (màu đỏ) và sau 24 giờ ủ (màu xanh lá cây)
Điện tích (A) và kích thước (B) của AgNPs là khác nhau đối với mỗi loại kháng sinh.
Một hiệu ứng tổng hợp đã được quan sát thấy đối với kết hợp Km + AgNPs và Amp + AgNPs (được đánh dấu bằng mũi tên). Hình ảnh được chụp sau 24 giờ ủ.
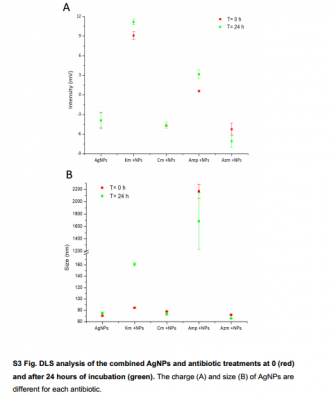
Hình S5. Hình ảnh TEM của các tế bào vi khuẩn tiếp xúc với nồng độ AgNPs và kháng sinh trong sublethal
E . coli , S . Typhimurium, S . aureus và B . subtilis đã được tiếp xúc với các phương pháp điều trị kết hợp trong 24 giờ. Hình ảnh đại diện được hiển thị.
Nguồn tham khảo: Enhancement of antibiotics antimicrobial activity due to the silver nanoparticles impact on the cell membrane
NANO NNA VIỆT NAM